Quante volte ti sei trovato a fissare la tavola periodica, sentendoti sopraffatto da sigle e numeri? La chimica, a volte, sembra un linguaggio alieno. Oggi, però, affrontiamo una piccola parte di questo universo: gli isotopi dell'idrogeno. Non preoccuparti, renderemo il viaggio il più semplice e chiaro possibile. Immagina di voler conoscere meglio un amico: non ti limiti a sapere il suo nome, ma cerchi di scoprire le sue particolarità. Con gli isotopi dell'idrogeno faremo proprio questo!
Cosa Sono gli Isotopi?
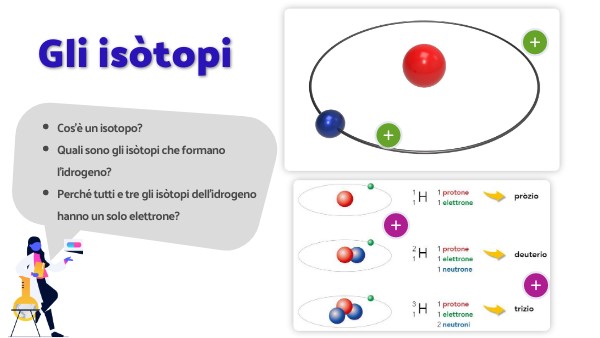
Prima di parlare specificamente dell'idrogeno, è fondamentale capire cosa sono gli isotopi in generale. Immagina che ogni elemento chimico sia come una grande famiglia. All'interno di questa famiglia, ci sono dei "cugini" che si assomigliano molto, ma hanno qualche piccola differenza: questi sono gli isotopi.
In termini chimici, gli isotopi sono atomi dello stesso elemento (stesso numero di protoni) che hanno un diverso numero di neutroni nel nucleo. Ricorda: il numero di protoni definisce l'elemento, mentre il numero di neutroni determina l'isotopo specifico.
Come spiega il Prof. Vincenzo Aquilanti, rinomato chimico teorico, "La comprensione degli isotopi è cruciale per interpretare correttamente le reazioni chimiche e le proprietà fisiche delle sostanze."
Gli Isotopi dell'Idrogeno: Un Tris Speciale
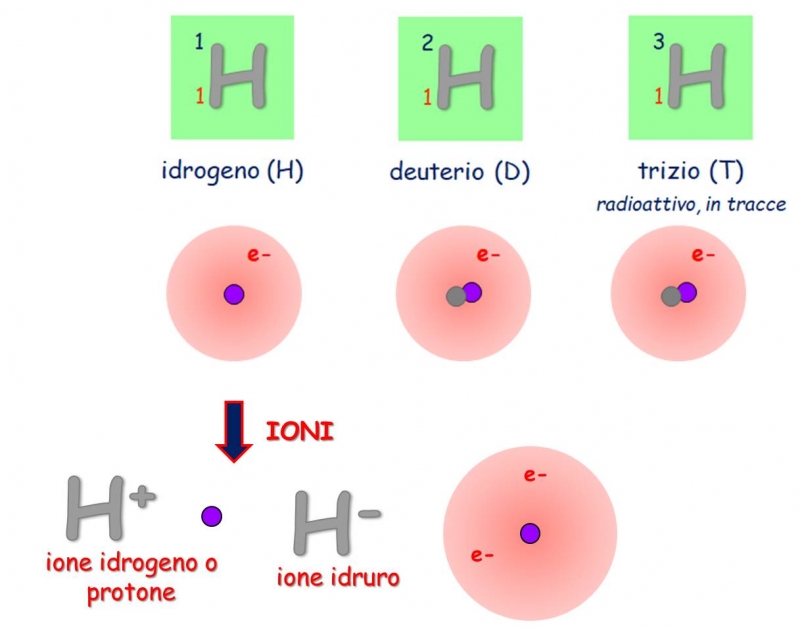
L'idrogeno è l'elemento più semplice e abbondante dell'universo. Ma la sua semplicità nasconde una complessità interessante: ha tre isotopi principali. Ognuno con un nome e delle proprietà specifiche.
1. Prozio (1H)
Il prozio, chiamato anche idrogeno leggero, è l'isotopo più comune. Il suo nucleo è composto da un solo protone e nessun neutrone. È l'idrogeno che troviamo nell'acqua (H2O) e nella maggior parte delle molecole organiche. La sua abbondanza è di circa il 99,9885% dell'idrogeno presente in natura.

Pensa al prozio come all'idrogeno "standard", quello che ti viene subito in mente quando senti parlare di questo elemento.
2. Deuterio (2H o D)
Il deuterio è un isotopo "più pesante" dell'idrogeno. Il suo nucleo contiene un protone e un neutrone. Questo lo rende circa il doppio più pesante del prozio. La sua abbondanza naturale è molto inferiore, circa lo 0,0115%.
L'acqua contenente deuterio al posto del prozio è chiamata "acqua pesante" (D2O). L'acqua pesante ha proprietà leggermente diverse dall'acqua normale e viene utilizzata, ad esempio, nei reattori nucleari.
Il deuterio è importante in diverse applicazioni scientifiche. Uno studio pubblicato su "Nature" ha dimostrato come l'uso di composti deuterati possa aumentare la stabilità e la durata di alcuni farmaci.
3. Trizio (3H o T)
Il trizio è un isotopo radioattivo dell'idrogeno. Il suo nucleo contiene un protone e due neutroni. Questo lo rende il più pesante dei tre isotopi. Il trizio è molto raro in natura ed è principalmente prodotto artificialmente nei reattori nucleari.
Il trizio decade tramite decadimento beta con un'emivita di circa 12,3 anni. Questo significa che, dopo 12,3 anni, metà di una quantità di trizio si sarà trasformata in elio-3. A causa della sua radioattività, il trizio viene utilizzato in applicazioni specifiche, come la datazione radiometrica e l'illuminazione di emergenza.

Attenzione: a causa della sua radioattività, è fondamentale maneggiare il trizio con estrema cautela e seguendo le normative di sicurezza appropriate.
Tabella Comparativa degli Isotopi dell'Idrogeno
Per riassumere le differenze tra i tre isotopi, ecco una tabella:
| Isotopo | Simbolo | Numero di Protoni | Numero di Neutroni | Abbondanza Naturale | Radioattivo? |
|---|---|---|---|---|---|
| Prozio | 1H | 1 | 0 | 99.9885% | No |
| Deuterio | 2H o D | 1 | 1 | 0.0115% | No |
| Trizio | 3H o T | 1 | 2 | Tracce (principalmente artificiale) | Sì |
Come Ricordare gli Isotopi dell'Idrogeno?
Ecco alcuni trucchi per memorizzare meglio le caratteristiche di questi isotopi:

- Prozio: Pensa al "pro" come "primo" o "principale". È l'idrogeno più comune, il "primo" che impari.
- Deuterio: Associa "deu" a "due", per ricordare che ha un protone e un neutrone.
- Trizio: Immagina "tri" come "tre" (particelle nel nucleo: un protone e due neutroni) e ricordati che è "tossico" (radioattivo).
Applicazioni Pratiche e Strumenti Utili
Ora che conosci gli isotopi dell'idrogeno, come puoi applicare queste conoscenze?
- Chimica Organica: Comprendere l'effetto isotopico cinetico. La velocità di una reazione chimica può variare a seconda dell'isotopo presente. Ad esempio, se una reazione che rompe un legame C-H è più lenta quando si usa un legame C-D (deuterio).
- Spettrometria di Massa: Questa tecnica analitica permette di identificare e quantificare diversi isotopi in un campione. Puoi usare spettri di massa simulati (online) per esercitarti ad identificare la presenza di deuterio o trizio in una molecola.
- Ricerca: Approfondisci le applicazioni del deuterio e del trizio nella ricerca medica e ambientale. Ad esempio, la marcatura con deuterio è utilizzata per studiare il metabolismo dei farmaci.
Esistono anche diverse risorse online che possono aiutarti ad approfondire la tua conoscenza degli isotopi dell'idrogeno:
- Khan Academy: Offre lezioni gratuite sulla chimica e sulla struttura atomica.
- Chem LibreTexts: Una libreria online collaborativa di testi di chimica, che include sezioni sugli isotopi.
Conclusione
Gli isotopi dell'idrogeno, pur essendo parte di un elemento semplice, rappresentano un argomento affascinante con applicazioni in diversi campi scientifici. Speriamo che questa guida ti abbia aiutato a comprendere meglio cosa sono, quali sono e come si differenziano tra loro. Non aver paura di approfondire ulteriormente: la chimica è un viaggio di scoperta continuo! Come diceva Marie Curie, "Non si deve temere nulla nella vita, si deve solo capire. Ora è il momento di capire di più, in modo da temere di meno."