
Quante volte vi siete sentiti persi nel labirinto delle leggi della termodinamica? Studenti che lottano per capire i concetti, genitori che cercano di aiutare i figli con i compiti, insegnanti che si sforzano di rendere la materia interessante: capiamo tutti le difficoltà. Il Primo e il Secondo Principio della Termodinamica possono sembrare ostacoli insormontabili, ma in realtà, sono strumenti potenti per comprendere il mondo che ci circonda. Cercheremo di svelare questi principi in modo chiaro e accessibile, usando esempi pratici e un linguaggio semplice.
Il Primo Principio: Conservazione dell'Energia
Il Primo Principio della Termodinamica è, nella sua essenza, una dichiarazione della legge di conservazione dell'energia. In termini semplici, afferma che l'energia non può essere creata né distrutta, ma solo trasformata da una forma all'altra. Potete immaginarlo come un bilancio energetico: tutto ciò che entra deve uscire, anche se in una forma diversa.
Definizione formale: La variazione dell'energia interna di un sistema termodinamico è uguale al calore scambiato con l'ambiente esterno meno il lavoro compiuto dal sistema sull'ambiente esterno.
Matematicamente, questo si esprime come:
ΔU = Q - L
Dove:
- ΔU è la variazione dell'energia interna del sistema.
- Q è il calore scambiato (positivo se il sistema assorbe calore, negativo se lo cede).
- L è il lavoro compiuto dal sistema (positivo se il sistema compie lavoro sull'ambiente, negativo se l'ambiente compie lavoro sul sistema).
Esempi pratici:
- Riscaldare l'acqua: Quando riscaldiamo l'acqua su un fornello, l'energia termica (calore) fornita dal fornello viene trasferita all'acqua, aumentando la sua energia interna e quindi la sua temperatura. Nessuna energia viene creata o distrutta, solo trasferita.
- Un motore a scoppio: In un motore a scoppio, l'energia chimica del combustibile viene trasformata in energia termica tramite la combustione. Questa energia termica viene poi convertita in energia meccanica, che fa muovere il pistone e quindi il veicolo. Ancora una volta, l'energia viene semplicemente trasformata.
- Una lampadina: Una lampadina converte l'energia elettrica in energia luminosa ed energia termica (calore). Parte dell'energia elettrica viene persa sotto forma di calore, motivo per cui le lampadine diventano calde.
In classe: Per aiutare gli studenti a comprendere il Primo Principio, si possono utilizzare esperimenti semplici come misurare la temperatura dell'acqua prima e dopo averla riscaldata, oppure osservare come un elastico si riscalda quando viene stirato rapidamente. Questi esperimenti tangibili rendono il concetto più concreto.
Il Secondo Principio: L'Entropia e la Direzione del Tempo
Il Secondo Principio della Termodinamica è un po' più sottile e complesso del primo, ma è altrettanto fondamentale. Introduce il concetto di entropia, spesso definita come una misura del disordine o della casualità di un sistema. Il Secondo Principio afferma che l'entropia di un sistema isolato tende sempre ad aumentare nel tempo.

In parole semplici: i processi spontanei avvengono sempre in una direzione che aumenta il disordine. Un bicchiere che cade e si rompe, un cubetto di ghiaccio che si scioglie in una stanza calda, il profumo che si diffonde in un ambiente: tutti questi processi sono irreversibili e aumentano l'entropia.
Definizione formale: In un processo reversibile, la variazione di entropia (ΔS) è definita come il calore scambiato (Q) diviso per la temperatura assoluta (T):
ΔS = Q/T
Per un processo irreversibile, ΔS > Q/T. In un sistema isolato, l'entropia totale non diminuisce mai (ΔS ≥ 0).
Esempi pratici:

- Un puzzle: Un puzzle completato ha un basso livello di entropia (è molto ordinato). Quando smontiamo il puzzle e spargiamo i pezzi, l'entropia aumenta (è molto disordinato). È molto facile smontare un puzzle, ma rimontarlo richiede energia e lavoro.
- La muffa sul pane: Il pane fresco ha un basso livello di entropia. Con il tempo, la muffa cresce e il pane si deteriora, aumentando l'entropia. È impossibile invertire questo processo spontaneamente.
- Un gas che si espande: Se apriamo un contenitore pieno di gas in un ambiente vuoto, il gas si espanderà per riempire l'intero ambiente. Questo processo è irreversibile perché è estremamente improbabile che il gas si ricompatti spontaneamente nel contenitore originale.
Implicazioni del Secondo Principio:
- Irreversibilità: La maggior parte dei processi naturali sono irreversibili. Possiamo bruciare un pezzo di legno, ma non possiamo riassemblare le ceneri nel legno originale.
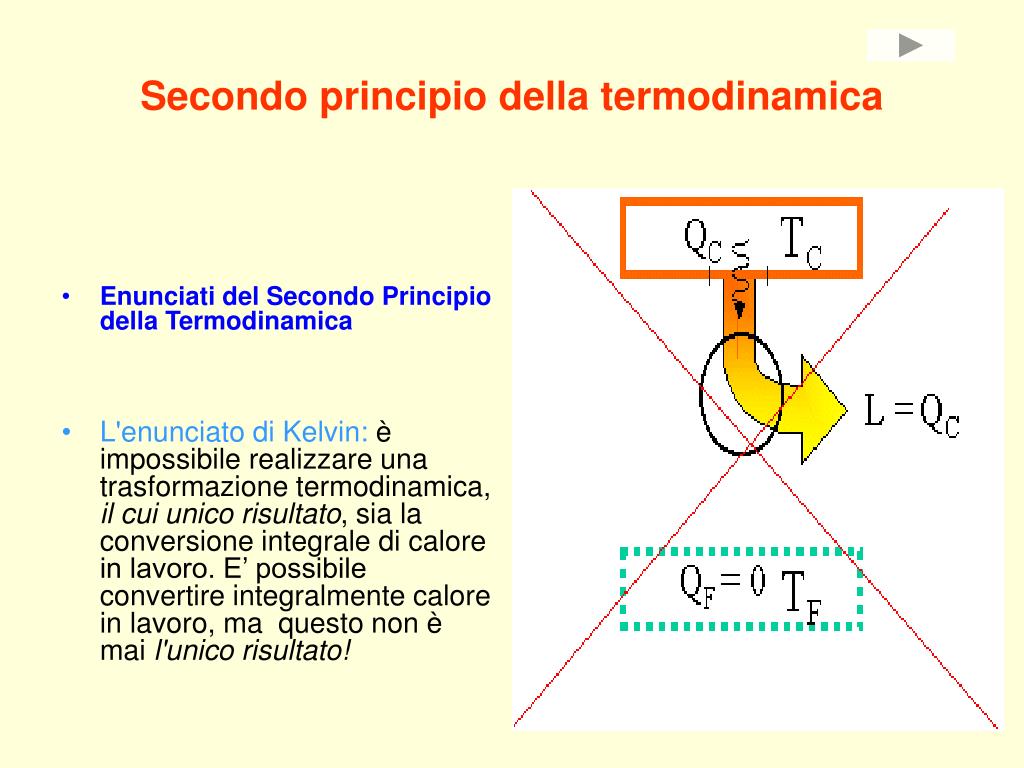
- Limiti all'efficienza: Il Secondo Principio pone un limite all'efficienza delle macchine termiche. Non è possibile convertire completamente il calore in lavoro senza produrre un aumento di entropia nell'ambiente.
- La direzione del tempo: Il Secondo Principio ci fornisce una "freccia del tempo". Possiamo distinguere il passato dal futuro osservando l'aumento di entropia. Un video che mostra un bicchiere che si ricompone spontaneamente sarebbe chiaramente un video riprodotto al contrario.
In classe: Per spiegare l'entropia, si può usare l'esempio di una stanza disordinata. Chiedete agli studenti di immaginare una stanza perfettamente ordinata e poi di confrontarla con una stanza disordinata. Quale stato è più probabile che si verifichi spontaneamente? Si può anche usare l'esempio di un mazzo di carte: un mazzo ordinato per seme e valore ha bassa entropia, mentre un mazzo mescolato ha alta entropia.

Il Secondo Principio e l'Universo
Il Secondo Principio ha implicazioni profonde per la comprensione dell'universo. Poiché l'entropia tende sempre ad aumentare, l'universo sta diventando sempre più disordinato e caotico. Alcuni scienziati ritengono che questo processo porterà alla "morte termica" dell'universo, uno stato in cui l'energia è distribuita uniformemente e non è più possibile compiere lavoro.
Conclusione: L'importanza dei Principi della Termodinamica
I Principi della Termodinamica sono fondamentali per la fisica, la chimica, l'ingegneria e molte altre discipline. Ci aiutano a comprendere il comportamento dell'energia, la direzione dei processi spontanei e i limiti delle macchine termiche. Anche se possono sembrare astratti, hanno implicazioni pratiche che influenzano la nostra vita quotidiana.
Speriamo che questa spiegazione abbia contribuito a demistificare il Primo e il Secondo Principio della Termodinamica. Ricordate, la chiave per la comprensione è la pratica e l'applicazione dei concetti a esempi concreti. Non abbiate paura di sperimentare, di porre domande e di esplorare il meraviglioso mondo della termodinamica!